Contenu
- Différence principale
- Isotopes vs isobares
- Tableau de comparaison
- Que sont les isotopes?
- Exemple
- Que sont les isobares?
- Exemple
- Différence clé
- Conclusion
Différence principale
La principale différence entre les isotopes et les isobares est que les isotopes sont les atomes du même élément ayant le même numéro atomique mais le nombre de masse différent, alors que les isobares sont les éléments ayant les mêmes masses atomiques mais un nombre de protons différent.
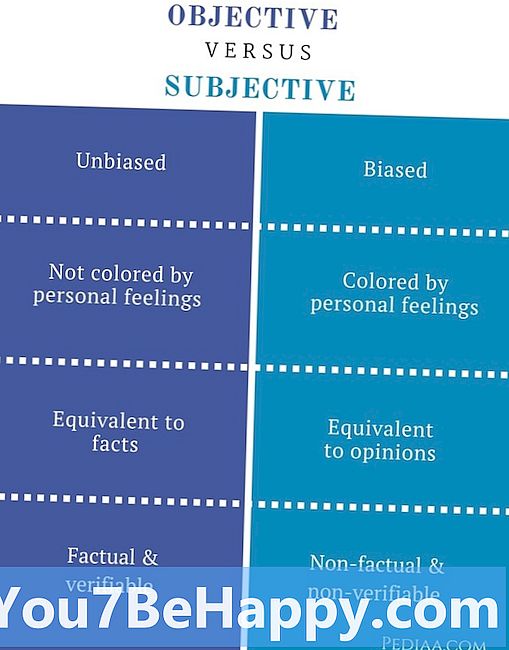
Isotopes vs isobares
Les isotopes sont les atomes d'un même élément ayant le même nombre de protons mais un nombre de masse différent, alors que les isobares sont l'élément ayant le même nombre de masse mais un nombre de protons différent. Les isotopes sont des atomes d'éléments ayant des structures atomiques différentes, tandis que les isobares sont les éléments chimiques qui ont les mêmes masses atomiques. Les isotopes sont les mêmes éléments de formes différentes, alors que les isobares sont les différents éléments. Les isotopes ont des propriétés identiques, telles que les propriétés chimiques, tandis que les isobares ont des propriétés différentes, telles que les propriétés chimiques. Les isotopes ont des propriétés physiques différentes, tandis que les isobares ont des propriétés physiques similaires. Les isotopes ont le même nombre d'électrons, alors que les isobares ont un nombre différent d'électrons. Les isotopes ont la même configuration électronique, tandis que les isobares ont une configuration électronique différente. Les isotopes peuvent être séparés par des propriétés physiques, tandis que les isobares peuvent être séparés par des propriétés chimiques.
Tableau de comparaison
| Les isotopes | Isobars |
| Les isotopes sont les atomes du même élément ayant le même nombre de protons mais un nombre de masse différent. | Les isobares sont les éléments ayant le même nombre de masse mais un nombre de protons différent. |
| Numéro atomique | |
| Avoir le même numéro atomique | Avoir un numéro atomique différent |
| Nombre de masse | |
| Avoir un numéro de masse différent | Avoir le même nombre de masse |
| Propriétés physiques | |
| Avoir des propriétés physiques différentes | Ont les mêmes propriétés physiques |
| Propriétés chimiques | |
| Ont les mêmes propriétés chimiques | Avoir différentes propriétés chimiques |
| Numéro d'électron | |
| Avoir le même numéro d'électron | Avoir un numéro électronique différent |
| Séparation | |
| Peut être séparé par des moyens physiques | Peut être séparé par des moyens chimiques |
| Configuration électronique | |
| Même configuration électronique | Avoir une configuration électronique différente |
| Éléments chimiques | |
| Mêmes éléments chimiques | Différents éléments chimiques |
| Structure atomique | |
| Structure atomique différente | Même structure atomique |
Que sont les isotopes?
Les isotopes sont des types d'atomes d'un élément qui ont toujours le même numéro de proton mais qui n'ont pas le même nombre de nucléons dans le tableau périodique. Les isotopes ont une structure différente de l'atome. Les isotopes ont un nombre égal d'électrons. Ils ont exactement la même place dans le tableau périodique moderne. Ils ont des demi-vies différentes. Les isotopes ont des propriétés physiques différentes. Mais ils ont aussi des propriétés similaires, telles que les propriétés chimiques. Les isotopes peuvent être séparés physiquement en utilisant le spectrographe de masse. Les isotopes ont également une configuration électronique similaire. Mais ils n'ont pas non plus le même nombre de neutrons. Les isotopes ont également un nombre similaire et égal d'électrons et de protons. Les isotopes sont également les mêmes types d'éléments chimiques. Les isotopes ont des propriétés chimiques similaires car les propriétés chimiques dépendent du nombre d'électrons et que le nombre d'électrons est le même dans les isotopes. Les isotopes ont des propriétés physiques différentes, car les propriétés physiques dépendent du nombre de masses et du nombre de neutrons, et le nombre de neutrons et le nombre de nucléons sont différents dans les isotopes. Cette propriété unique est également très utile pour la séparation des isotopes. Les isotopes sont identifiés par le numéro de masse ou le numéro de nucléon. Il existe de nombreux isotopes différents dans la nature ou pouvant être produits par désintégration artificielle.
Exemple
Trois isotopes d'hydrogène 1H1,1H2,1H3
Que sont les isobares?
Les isobares sont les éléments qui ont le même nombre de masses atomiques mais qui n'ont pas le même nombre de protons. Les isobares ont la même structure de l'atome. Les isobares n'ont pas le même nombre d'électrons. Ils ont également une position différente dans le tableau périodique. Ils ont des demi-vies différentes. Les isobares ont des propriétés similaires, telles que les propriétés physiques. Mais les isobares ont des propriétés qui ne sont pas les mêmes que ces propriétés chimiques. Les isobares peuvent être séparés par leurs propriétés chimiques. Les isobares ont également une configuration électronique différente dans le tableau périodique. Ils ont également des taux différents de réactions chimiques. Les isobares peuvent avoir ou non le même nombre de neutrons. Le nombre d'électrons et de neutrons est différent dans les isobares. Les isobares ont le même type d'éléments. Ils ont des propriétés chimiques différentes car les propriétés chimiques dépendent du nombre d'électrons et nous savons que le nombre d'électrons est différent dans les isobares. Les propriétés physiques sont les mêmes dans les isobares, car elles dépendent du nombre de nucléons et du nombre de neutrons et nous savons que le nombre de nucléons est le même dans les isobares. Ainsi, la propriété unique de différentes propriétés chimiques est très utile dans la séparation des isobares. Comme les isotopes sont identifiés par le numéro de masse, les mêmes isobares sont identifiées par le numéro de proton. Les isobares sont également dans la nature et peuvent être produits artificiellement. S'agissant de différents types d'éléments chimiques, leur position dans le tableau périodique est différente.
Exemple
Certains éléments sont appelés isobares en raison du même nombre de masse ou de nucléon, tels que le cobalt, le nickel, le cuivre, le fer. Ils ont le même numéro de masse atomique de 64.
Différence clé
- Les isotopes sont les atomes des mêmes éléments ayant le même numéro atomique, alors que les isobares ont un numéro atomique différent.
- Les isotopes ont un nombre de masse différent, alors que les isobares ont le même nombre.
- Les isotopes sont les mêmes éléments chimiques, alors que les isobares sont les différents éléments chimiques.
- Les isotopes ont également une configuration électronique similaire dans le tableau périodique, alors que les isobares ont une configuration électronique différente.
- Les isotopes ont le même nombre d'électrons, alors que les isobares ont un numéro d'électrons différent.
- Les isotopes ont la même position dans le tableau périodique, alors que les isobares ont une position différente dans le tableau périodique.
- Les isotopes ont le même type de propriétés chimiques, tandis que les isobares n’ont pas le même type de propriétés chimiques.
- Les isotopes ont des propriétés physiques différentes, alors que les isobares ont les mêmes propriétés physiques.
- Les isotopes ont des structures atomiques différentes, alors que les isobares ont la même structure atomique.
Conclusion
La discussion ci-dessus conclut que les isotopes et les isobares sont des termes du tableau périodique. Les isotopes sont les atomes des éléments ayant le même numéro atomique, alors que les isobares ont le même nombre de masse. Les isotopes ont un nombre de masse différent, alors que les isobares ont un numéro atomique différent. Les isotopes ont le même nombre d'électrons et de protons, tandis que les isobares ont le même nombre de neutrons.