Contenu
- Différence principale
- Protonation contre déprotonation
- Tableau de comparaison
- Qu'est-ce que la protonation?
- Qu'est-ce que la déprotonation?
- Différences Clés
- Conclusion
Différence principale
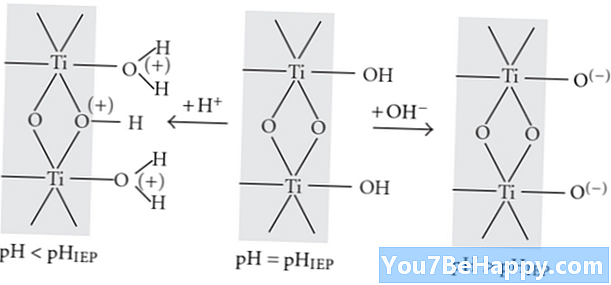
La principale différence entre la protonation et la déprotonation réside dans le fait que la protonation consiste à ajouter un proton dans un composé chimique, alors que la déprotonation consiste à éliminer un proton d'un composé chimique.
Protonation contre déprotonation
La protonation est le processus chimique qui se produit lors des réactions chimiques auxquelles un proton ajoute un composé chimique. Par ailleurs, la déprotonation est le processus qui se produit pendant la réaction chimique au cours de laquelle le proton est éliminé d’un composé chimique. La protonation est l'augmentation de la charge +1 dans un atome, une molécule, un ion ou un composé; par contre, la déprotonation est la diminution de la charge +1 de l'atome, de l'ion, de la molécule ou d'un composé.
L'atome, la molécule ou un composé impliqué dans la protonation s'appelle la base; sur le revers, l'atome, la molécule ou un composé qui participe à la déprotonation est appelé l'acide. La protonation est le processus par lequel le pH du composé chimique augmente; au contraire, la déprotonation est le processus par lequel le pH de la solution d’un composé chimique diminue.
La protonation est le processus d'addition, alors que la déprotonation consiste à supprimer ou à éliminer le processus. La protonation est le processus chimique dans lequel l'énergie ajoutée dans les réactions chimiques; sur le revers la déprotonation est le processus chimique dans lequel l'énergie libérée au cours des réactions. En d'autres termes, la protonation est l'ajout de H+ dans le composé chimique; la déprotonation consiste en l’élimination du H+ à partir d'un composé chimique.
La protonation augmente la charge de l'atome, de l'ion ou d'une molécule; D'un autre côté, la déprotonation diminue la charge de l'ion, de l'atome ou d'une molécule. Les bases subissent toujours des processus chimiques de la protonation lors des réactions acide-base; par contre, les acides subissent toujours les processus chimiques de la déprotonation lors des réactions acide-base.
La protonation est le processus chimique de production d’acides conjugués au cours des processus chimiques; sur le revers la déprotonation est le processus chimique de production de la base conjuguée au cours du processus chimique. La protonation provoque toujours la production de molécules d'eau à partir des groupes hydroxyle du composé dans les processus chimiques; D'un autre côté, la déprotonation entraîne toujours la production de molécules d'hydroxyle à partir des molécules d'eau dans les processus chimiques.
La protonation est un processus chimique très rapide lors des réactions organiques; par contre, la déprotonation est un processus très lent lors des réactions organiques. La protonation est le processus chimique qui stimule le processus d'isomérisation, alors que le processus chimique qui stimule le processus d'isomérisation. La protonation est la vitesse croissante du caractère acide; D'un autre côté, la déprotonation est le taux croissant de caractère de base.
Tableau de comparaison
| Protonation | Déprotonation |
| La protonation est l'ajout d'un proton dans un composé chimique. | La déprotonation consiste à éliminer un proton d’un composé chimique. |
| Protons | |
| Protons ajouter dans un composé | Les protons se retirent du composé |
| Charge | |
| Il augmente la charge +1 de la molécule | Il diminue la charge +1 de la molécule |
| Taux d'acidité ou de base | |
| Taux de basicité | Taux d'acidité |
| Le pH du composé | |
| Il augmente le pH du composé | Il diminue le pH du composé |
| Rapidité du processus | |
| C'est un processus rapide | C'est un processus lent |
| Processus d'isomérisation | |
| Stimule le processus d'isomérisation | Inhiber le processus d'isomérisation |
| L'énergie du processus | |
| Il ajoute de l'énergie à la réaction | Il libère l'énergie des réactions |
| Type de processus | |
| Processus d'ajout | Processus d'élimination |
| H+ Ion | |
| Les ions hydrogène ajoutent le composé | Les ions d'hydrogène éliminent du composé |
| Réversibilité | |
| C'est le processus réversible | C'est le processus irréversible |
| Capacité catalytique | |
| Il a le pouvoir catalytique | Il n'a pas de pouvoir catalytique |
Qu'est-ce que la protonation?
La protonation est le processus chimique consistant à ajouter un proton dans les composés chimiques lors des réactions chimiques. C'est un processus très rapide. Il peut former les molécules d'eau à partir des molécules d'hydroxyle. La protonation est le processus réversible qui augmente la charge du composé chimique d'un taux de +1 charge dans un atome, un ion, des molécules ou une espèce.
Le pH des solutions ou solvants impliqués dans la protonation est très bas. La protonation est le taux de basicité ou d’acidité des composés chimiques ou organiques. La protonation est l'addition ou le processus endothermique impliqué dans le processus d'isomérisation. Il stimule également le processus de polymérisation.
Il a le pouvoir catalytique d'augmenter l'acidité des réactions utilisées dans plusieurs processus tels que les réactions d'addition, les réactions nucléophiles, électrophiles, les réactions de substitution, etc. Le processus de protonation est proportionnel au degré de caractère acide de la substance. Cela implique généralement la formation de molécules d'eau au cours du processus.
Les ions hydrogène se sont toujours ajoutés au composé chimique pendant le processus de protonation. Il a également sa capacité à faire varier les caractéristiques optiques de la molécule. Le processus de protonation des composés dépend de l'acidité des acides disponibles pour les solutions ou les solvants. Le processus de protonation est utilisé pour diminuer la réactivité des molécules organiques. La protonation est généralement connue comme le processus endothermique qui consiste à libérer l’énergie en donnant le proton à l’espèce chimique très facilement.
Le processus comme l’addition d’hydrogène dans la molécule d’ammoniac qui entraîne la formation d’ions ammonium, l’ajout d’ions hydrogène dans les molécules d’eau pour produire les ions hydronium, la protonation de l’ion hydroxyle pour former les molécules d’eau, l’ajout d’ions hydrogène aux alcools pour former les ions hydronium dans la solution, l’ajout d’ions hydrogène aux alcènes et aux alcynes, etc. explique le mieux le terme protonation.
Qu'est-ce que la déprotonation?
La déprotonation est le processus chimique d'élimination des protons des composés chimiques au cours des réactions chimiques. C'est un processus lent. Ce processus a également la capacité de former des ions hydroxyles à partir des molécules d’eau. La déprotonation est le processus irréversible qui a la capacité de diminuer la charge du composé chimique d'un taux de +1 charge dans un atome, une molécule ou une espèce ionique.
Le pH des solutions ou des solvants impliqués dans le processus de déprotonation est très élevé. Ce processus n'a pas la capacité d'effectuer des réactions chimiques en agissant comme catalyseur. Le processus de protonation est proportionnel au caractère fondamental de la substance. Les ions hydrogène sont toujours éliminés du composé chimique lors du processus de déprotonation. Ses activités optiques sont également variables.
Le processus de déprotonation dépend également du pH des solutions ou des solvants. Ce processus augmente la réactivité des molécules organiques. Les processus tels que l'élimination des ions hydrogène de l'eau pour former des ions hydroxyles, l'élimination d'un proton des alcanes pour former les alcènes et les alcynes, l'élimination des ions hydrogène des alcools, etc., expliquent le mieux le terme de déprotonation.
Différences Clés
- La protonation est le phénomène d'addition de protons; par contre, la déprotonation est le phénomène de l’élimination des protons.
- La protonation augmente toujours le pH de la solution chimique; D'un autre côté, la déprotonation diminue toujours le pH de la solution chimique.
- La protonation ajoute toujours la charge +1 au composé chimique; en revanche, la déprotonation élimine toujours la charge +1 du composé chimique.
- La protonation est la vitesse croissante du caractère acide; D'un autre côté, la déprotonation est le taux croissant de caractère de base.
- La protonation se produit très rapidement. en revanche, la déprotonation se produit très lentement.
- Bases généralement utilisées dans le processus de protonation en acceptant le proton; au contraire; la déprotonation généralement utilisée dans le processus de déprotonation en éliminant les protons.
- L'addition d'énergie se produit dans le processus de protonation; D'un autre côté, l'élimination de l'énergie se produit dans le processus de déprotonation.
- La protonation augmente la charge de l'atome, de l'ion ou d'une molécule; D'un autre côté, la déprotonation diminue la charge de l'ion, de l'atome ou d'une molécule.
- Le processus de protonation implique l’isomérisation des substances chimiques; d'autre part, le processus de déprotonation n'entraîne pas l'isomérisation des substances chimiques.
- La protonation est le processus chimique qui se produit dans les bases lors des réactions acide-base. D'un autre côté, la déprotonation est le processus chimique qui se produit dans les acides au cours des réactions acide-base.
- La protonation produit toujours l'acide conjugué dans le processus chimique; au contraire, la déprotonation produit toujours la base conjuguée dans le processus chimique.
- La protonation rend la solution plus concentrée; D'un autre côté, la déprotonation rend la solution moins concentrée.
- La protonation implique la fabrication des molécules d’eau; en revanche, la déprotonation implique la fabrication des molécules d'hydroxyle.
- La protonation est le processus endothermique. La déprotonation est en revanche le processus exothermique.
Conclusion
La discussion ci-dessus conclut que la protonation est l'augmentation de la charge +1 du composé chimique; La déprotonation est en revanche la diminution de la charge +1 du composé chimique.


