Contenu
- Différence principale
- Estérification contre. Saponification
- Tableau de comparaison
- Qu'est-ce que l'estérification??
- Quelle est la saponification?
- Différences Clés
- Conclusion
Différence principale
La principale différence entre l'estérification et la saponification est que l'estérification est responsable de la formation d'un ester à partir d'un alcool et d'un acide carboxylique, tandis que la saponification est responsable de la décomposition des esters en alcool et en acide carboxylique.
Estérification contre. Saponification
Les esters sont appelés composés organiques, qui sont essentiellement composés d'atomes de H, de C et de O. La présence du groupe –COOR montre qu'une molécule spécifique est un ester. En raison de la présence d'atomes d'oxygène, les esters deviennent des composés polaires. Ils sont également impliqués dans la formation de liaisons hydrogène avec beaucoup d'autres composés.
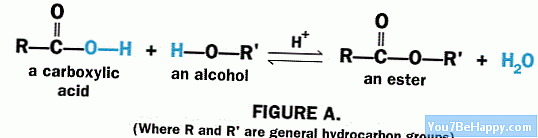
Un ester est apparu lorsqu'une réaction s'est produite entre un acide carboxylique et un alcool, et un catalyseur est également utilisé pendant sa formation. Il s'agit essentiellement d'un catalyseur acide. Ce type de formation s'appelle l'estérification. Le processus opposé à l'estérification est appelé saponification.
Le processus d'estérification se déroule en présence d'un catalyseur responsable de la réduction du seuil d'énergie d'activation de la réaction. Ce catalyseur est généralement un catalyseur acide. La saponification, en revanche, a lieu en milieu aqueux, où la présence d'une base est également essentielle. En raison de la présence des conditions basiques du milieu, l’anion carboxylate est considéré comme plus stable que la forme acide carboxylique. L'ion carboxylate se détache de l'ester pour cette raison. Le mélange réactionnel doit être chauffé pour séparer la liaison C-OH de l'acide carboxylique afin d'éliminer le groupe -OH.
Le processus d'estérification a besoin d'énergie. À l'inverse, la saponification n'a pas de barrière énergétique et peut donc se dérouler sans énergie thermique. Dans cette réaction, les molécules d’eau dans le milieu aqueux offrent H+ des ions pour la formation d'alcool, et la base offre OH– les ions nécessaires à la formation d'acide carboxylique.
Tableau de comparaison
| Estérification | Saponification |
| L'estérification est un processus responsable de la formation d'un ester à partir d'un alcool et d'un acide carboxylique. | La saponification est un processus responsable de la décomposition des esters en alcool et en acide carboxylique. |
| Type de réaction | |
| L'estérification est une réaction en avant. | La saponification est une réaction en arrière. |
| Réactifs | |
| Les réactifs de ce procédé sont l'acide carboxylique et un alcool. | Les réactifs de ce processus sont de l’eau, une base et un ester. |
| Des produits | |
| Les produits finaux du processus d'estérification sont de l'eau et de l'ester. | Les produits finaux du processus de saponification sont l’alcool et l’ion carboxylate. |
| Catalyseur | |
| Le catalyseur utilisé dans le processus d'estérification est un acide. | Le catalyseur utilisé dans le processus de saponification est une base. |
| Énergie | |
| L'estérification nécessite de l'énergie, fournie sous forme de chaleur. | Aucune énergie externe n'est nécessaire pendant le processus de saponification. |
Qu'est-ce que l'estérification??
L'estérification est le processus responsable de la formation d'un ester à partir d'un alcool et d'un acide carboxylique. La réaction nécessite également un catalyseur pour diminuer le problème d'énergie d'activation de la réaction, et le catalyseur doit être un catalyseur acide. Ce processus a besoin d'énergie.
Afin d'éliminer le groupe -OH, le mélange réactionnel a besoin de chaleur pour couper la liaison C-OH de l'acide carboxylique. La réaction a lieu lorsque le proton du groupe -OH de l'alcool et du groupe -OH de l'acide carboxylique est éliminé. Ensuite, le nucléophile alcoolique et le cation carboxylique réagissent l'un avec l'autre et forment l'ester.
Les sous-produits de cette réaction sont les molécules d’eau. Le proton que nous avions retiré de l'alcool réagit avec le groupe -OH, qui à son tour a été éliminé de l'acide carboxylique, formant ainsi une molécule d'eau.
On peut obtenir un ester pur en ajoutant un agent déshydratant. Un excès d'alcool est ajouté pour obtenir un rendement élevé en ester. Nous pouvons également utiliser un agent déshydratant capable d’éliminer l’eau produite lors de cette réaction. Nous pouvons également utiliser d'autres méthodes pour éliminer l'eau, comme la distillation.
Quelle est la saponification?
La saponification est le processus responsable de la décomposition des esters en alcool et en acide carboxylique. Les réactifs utilisés pour effectuer ce procédé sont l'acide carboxylique et un alcool. Le catalyseur utilisé dans ce type de procédé est une base. L'énergie n'est pas requise par le processus de saponification.
Dans ce processus, l'atome de carbone de la liaison -COO- dans l'ester est attaqué par OH- de la base. En raison de la présence de deux atomes d'oxygène, les deux côtés de l'atome de carbone sont partiellement chargés positivement. Pour cette raison, il est considéré comme un objectif facile pour un nucléophile. Après cela, une liaison est établie avec l'atome de carbone par le groupe OH. Ensuite, afin de devenir stable, un réarrangement a lieu. C’est à ce moment que le groupe -OR de l’alcool se libère, lequel est à son tour responsable de la fabrication de l’acide carboxylique et est considéré comme le groupe partant de cette réaction.
L'acide carboxylique résultant est déprotoné, car l'ion carboxylate est considéré comme plus stable dans le milieu basique. Le proton éliminé est réservé par le groupe –OR pour la formation d'alcool.
Différences Clés
- L'estérification est le processus responsable de la formation d'un ester à partir d'un alcool et d'un acide carboxylique, tandis que la saponification est le processus responsable de la décomposition des esters en alcool et en acide carboxylique.
- L'estérification est une réaction en avant; Par contre, la saponification est une réaction en arrière.
- L'estérification est ce type de processus qui nécessite de l'énergie. L'énergie est fournie sous forme de chaleur. Inversement, la saponification est ce type de processus qui ne nécessite aucune énergie extérieure.
- Les réactifs utilisés dans le processus d'estérification sont l'acide carboxylique et un alcool, en revanche, les réactifs utilisés dans le processus de saponification sont l'eau, une base et un ester.
- Les produits finis obtenus par le procédé d'estérification sont de l'eau et de l'ester. En revanche, les produits finis obtenus par le procédé de saponification sont un alcool et un ion carboxylate.
- Le catalyseur que nous utilisons dans le processus d'estérification est un acide, de l'autre côté, le catalyseur que nous utilisons dans le processus de saponification est une base.
Conclusion
La discussion ci-dessus résume le fait que la saponification est un processus opposé à l'estérification. L'estérification est impliquée dans la synthèse de l'ester, alors que la saponification est la rupture de la liaison ester. Le premier a besoin d'énergie pour accomplir tandis qu'aucune énergie n'est requise pour le dernier.


